El lactosuero representa aproximadamente el 90% del volumen de la leche procesada para la producción de queso. Este subproducto contiene más del 50% de los nutrientes de la leche, entre los que se encuentran la lactosa, las proteínas solubles y los lípidos. Debido a la alta biodegradabilidad de este subproducto y a su elevado potencial para la producción de bioenergía y bioproductos, en los últimos años se han desarrollado nuevos conceptos de valorización basados en la economía circular.
Beatriz Molinuevo Salces, Berta Riaño Irazábal y María Cruz García González. Unidad de Tecnologías Ambientales Aplicadas al Sector Agroindustrial (TECAMB). Instituto Tecnológico Agrario de Castilla y León (Itacyl), Ctra. Burgos km. 119 (Finca Zamadueñas), C.P. 47071, Valladolid.
En 2018 se produjeron 10,3 millones de toneladas de queso en la Unión Europea (Eurostat, 2018). El principal subproducto que se obtiene en la producción de queso es el lactosuero, cuyo volumen representa aproximadamente el 90% del volumen dela leche procesada (Imeni y col., 2019).
En la actualidad, los principales usos de este subproducto incluyen la alimentación animal y la conversión del lactosuero en productos como polvo de suero, polvo de lactosa o concentrado de proteína. Además, en los últimos años se han desarrollado nuevos conceptos de valorización basados en la economía circular, debido al elevado potencial del lactosuero para la producción de bioenergía y bioproductos.
Entre ellos, se encuentran la obtención de biogás, la producción de biohidrógeno, las fermentaciones bacterianas para obtener ácido láctico o etanol, la producción de biopolímeros, su uso en sistemas bioelectroquímicos para generar electricidad y diversas combinaciones de tratamientos biológicos para su tratamiento y valorización (Asunisy col., 2020).
La composición del lactosuero depende del proceso de producción del queso y del origen de la leche utilizada. En general presenta baja alcalinidad y pH, contiene hasta un 95% del agua y más del 50% de los nutrientes de la leche, entre los que se encuentran la lactosa, las proteínas solubles, los lípidos y las sales minerales (Rico y col., 2015).
El proyecto Lactocyl “La bioeconomía aplicada a la valorización del lactosuero en alimentación, transformación energética y obtención de bioproductos” está financiado por los fondos FEADER y está coordinado por el Instituto Tecnológico Agrario de Castilla y León (Itacyl). Participan cinco empresas queseras de Castilla y León, altamente interesadas e implicadas en obtener resultados aplicables en sus queserías, y que podrían replicarse posteriormente al sector. El proyecto evalúa distintas estrategias de valorización de lactosuero.
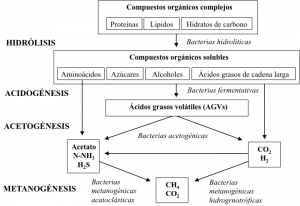
La digestión anaerobia es un proceso biológico mediante el cual se obtiene energía renovable en forma de biogás y se consigue una estabilización de la materia prima, normalmente un subproducto orgánico. Este proceso biológico comprende cuatro etapas de transformación biológica: hidrólisis, acidogénesis, acetogénesis y metanogénesis (figura 2).
La revalorización energética del lactosuero mediante digestión anaerobia se presenta como una alternativa muy apropiada para su valorización, dado que presenta una elevada carga orgánica con alta biodegradabilidad en condiciones anaerobias. Sin embargo, esta alta biodegradabilidad podría provocar una rápida acidificación del sistema debido a la formación de ácidos grasos volátiles (AGVs), lo que puede provocar la inestabilidad del proceso.
La co-digestión con otros subproductos con alta capacidad tampón puede disminuir esta acidificación y estabilizar el proceso. Esta estabilidad del proceso de digestión anaerobia es altamente dependiente de la composición de los sustratos. Por ello, para suplir las posibles deficiencias en nutrientes de sustratos con alta carga orgánica, se utiliza la co-digestión con otros sustratos ricos en nutrientes como son los residuos ganaderos (Molinuevo-Salces y col., 2015).
Dentro del proyecto Lactocyl, se evaluó el efecto de la adición de lactosuero en la co-digestión anaerobia con estiércol de vacuno, que permite obtener un proceso estable y al mismo tiempo, maximizar la producción de metano. Se evaluaron distintos porcentajes de lactosuero en la mezcla entre 0 y 60% (en base a SV).
Estos porcentajes se calcularon en base a la producción anual de estiércol de vacuno y lactosuero en una granja de vacuno de leche de tamaño medio (160 animales). De este modo la producción de estiércol sería de 55 kg por animal y día, resultando en 3.212 t de estiércol al año (Ramos, 2020).
La producción de leche sería de 9300 kg de leche por animal y año, y suponiendo que toda la leche se destina a la producción de queso, se obtendrían unos 1.339 t de lactosuero al año (MAPA, 2019). La ratio entre estiércol y lactosuero sería de 2.4 t de estiércol por tonelada de lactosuero lácteo. Por lo tanto, considerando que la densidad del estiércol es 1, la proporción de lactosuero en volumen no podría ser mayor del 41% en volumen (60% en sólidos volátiles), dadas las producciones estimadas de estiércol y leche para una granja de tamaño medio.
Origen y composición del lactosuero y del estiércol de vacuno
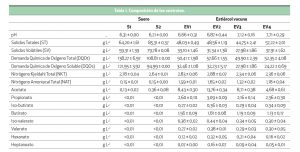
En este estudio, se utilizaron dos lactosueros, uno procedente de la transformación de leche de vaca pasteurizada (S1) y otro procedente de la transformación artesanal de leche de oveja cruda (S2). Los lactosueros se obtuvieron en dos empresas queseras localizadas en la provincia de Palencia y fueron congelados hasta su uso, para evitar su degradación.
El estiércol de vacuno (EV) se obtuvo en una granja de vacuno de leche localizada en la provincia de Valladolid. Se recogieron cuatro lotes de EV, denominados EV1, EV2, EV3 y EV4. El fango anaerobio que se utilizó como inóculo se recogió en la depuradora de aguas urbanas de la ciudad de Valladolid. El fango contenía 18,04 ± 0,05 y 11,81 ± 0,04 g L-1 de materia seca (sólidos totales, ST) y materia orgánica (sólidos volátiles, SV), respectivamente.
En la tabla 1 se presenta la composición química de los dos lactosueros y de los cuatro lotes de estiércol de vacuno utilizados durante el estudio. La composición química de los lactosueros fue similar en cuanto a pH, NKT y NAT. El S2 procedente de leche cruda de oveja presentó valores superiores de materia seca (ST) y materia orgánica (SV) que el S1, procedente de leche pasteurizada de vaca. La composición físico-química de los distintos lotes de estiércol de vacuno presentó una variabilidad elevada, especialmente en cuanto a pH, ST y SV se refiere.
Digestión anaerobia de lactosuero y estiércol de vacuno en semicontinuo
Para la evaluación de la digestión anaerobia, se utilizaron tres reactores de mezcla completa con un volumen de trabajo de 2 litros (figura 3). El reactor 1 (R1) se utilizó como control, para la digestión anaerobia del estiércol como sustrato único. El reactor 2 (R2) se usó para la co-digestión anaerobia del estiércol y el S1. El reactor 3 (R3) se usó para la co-digestión anaerobia del estiércol y el S2.
Se aseguró la homogeneización del contenido de los reactores mediante agitación magnética y la temperatura se mantuvo en 37 ± 1 °C. Los reactores se llenaron inicialmente con dos litros de fango anaerobio. Tras un día de aclimatación, se comenzó la alimentación manual de los reactores, con una frecuencia de 5 días por semana y un tiempo de residencia hidráulica de 20 días.
Los sustratos para R1, R2 y R3 se prepararon diariamente diluyendo el sustrato en agua cuando fue necesario. Se establecieron seis periodos de trabajo (PI, PII, PIII, PIV, PV y PVI). Estos periodos correspondieron con distintos porcentajes de lactosuero en la mezcla (en base a SV):10%, 20%, 30%, 40%, 50% y 60%, respectivamente. Teniendo en cuenta la humedad de los sustratos, y suponiendo que la densidad del estiércol es 1, estos porcentajes serían equivalentes al 4-6%, 9-11%, 13-17%, 22-30%, 27-36% y 35-47% en volumen de lactosuero, respectivamente. Se tomaron muestras semanalmente para determinar los siguientes parámetros: alcalinidad total (AT), alcalinidad parcial (AP), ST, SV, DQOt, DQOs, ácidos grasos volátiles (AGVs), NKT y NAT.
El volumen de biogás generado se midió diariamente por desplazamiento de agua y la composición del biogás se determinó una vez por semana mediante cromatografía de gases. Las diferencias entre tratamientos para cada periodo se analizaron estadísticamente mediante el análisis de varianza de un factor (ANOVA).
- Efecto del incremento del porcentaje de lactosuero en la mezcla sobre la producción de metano
En la figura 4se presenta el rendimiento o producción específica de metano para los tres reactores en los distintos periodos de trabajo. La producción de metano media para el estiércol de vacuno (R1) fue de 170 ± 40 mLCH4 g SV-1, con una riqueza en metano del biogás del 56.2%. Se observaron muchas variaciones en la producción de metano en R1, debido a las diferencias en composición físico-química de los distintos lotes de estiércol utilizados (EV1-EV4) durante los 250 días de experimentación (tabla 1). Estas variaciones observadas en R1 se reflejaron en las producciones de R2 y R3, cuyo sustrato base de co-digestión fue ese mismo estiércol.
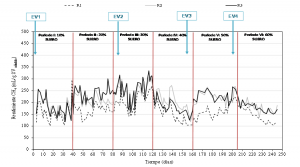
Figura 4. Rendimiento específico de metano. Las flechas indican los distintos lotes de estiércol utilizados durante la experimentación.
La adición de un 10% de lactosuero (4-6% en volumen de lactosuero) en la digestión anaerobia del estiércol de vacuno (PI) no produjo diferencias significativas en la producción de metano entre los tres reactores (figura 4). A partir de un 20% de lactosuero, las diferencias en la producción de metano fueron significativas entre el reactor control (R1, sólo estiércol) y los reactores de co-digestión (R2 y R3).
Los mejores rendimientos de metano, en comparación con R1, se obtuvieron en el periodo V, al añadir un 50% de lactosuero (27-36% en volumen de lactosuero) a la mezcla de co-digestión. Los valores medios obtenidos en el periodo V fueron 225 ± 26 ml CH4 g SV-1 y 229 ± 23 ml CH4 g SV-1, para R2 y R3, respectivamente. No se observaron diferencias significativas entre las dos co-digestiones de lactosuero (R2 y R3).
En la tabla 2 se muestran las cargas orgánicas, las eliminaciones de SV y DQOs y las características del biogás (rendimiento biogás, contenido en metano y rendimiento en metano) para R1, R2 y R3 en los distintos periodos de trabajo. La velocidad de carga orgánica introducida en los reactores estuvo en el rango de 1.5 – 2.0 g SV por litro de reactor y día, siendo dependiente del lote de estiércol utilizado en cada periodo.
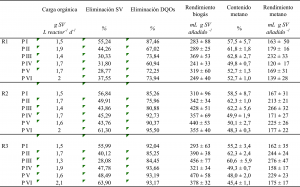
Tabla 2. Parámetros de operación, eliminaciones de SV y DQOs y características del biogás para R1, R2 y R3 en los distintos periodos de trabajo (PI – PVI).
La eliminación de sólidos volátiles y DQO soluble fue mayor para los reactores de co-digestión R2 y R3, siendo las diferencias más notables cuanta mayor cantidad de lactosuero se añadió a la mezcla. Con porcentajes de lactosuero entre 40-60% (22-47% de lactosuero en volumen) las eliminaciones de DQO soluble fueron del 90-95% y del 93-94% para R2 y R3, respectivamente. Esto representa hasta un 57% mayor biodegradabilidad que en R1, donde el sustrato fue únicamente estiércol de vacuno.
Respecto a las características del biogás obtenido, en R1 el porcentaje de metano en el biogás se situó de media en 56.2%. En el caso de R2 y R3 se observó una disminución en el contenido en metano en el biogás (tabla 2) a partir del periodo IV. Dado que esta disminución podría indicar una inestabilidad en el proceso se evaluaron distintos parámetros para estudiar la estabilidad del proceso.
- Evaluación de la estabilidad del proceso
Para evaluar la estabilidad del proceso de digestión anaerobia se utilizaron cuatro parámetros: 1) el pH en la mezcla, 2) la ratio entre la alcalinidad intermedia (AI) y la alcalinidad parcial (AP), 3) la concentración de AGVsen la mezcla, y 4) la concentración de NAT en la mezcla.
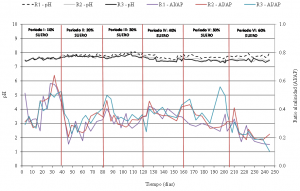
Como se observa en la figura 5, el pH se mantuvo en el rango 7-8 durante todo el tiempo de experimentación. Este rango de pH es el óptimo para el buen funcionamiento de las bacterias metanogénicas.
La alcalinidad total (AT) indica la capacidad que una disolución tiene para amortiguar los cambios de pH. La AP se asocia a la presencia de OH–, NH3, HCO3y CO3 y la alcalinidad intermedia (AI=AT-AP) se relaciona con la presencia de AGVs en la disolución. La ratio AI/AP se utiliza para evaluar la estabilidad del proceso de digestión anaerobia. Ratios por debajo de 0.3 son indicadores de un proceso estable. Este parámetro estuvo en general en el rango adecuado, observándose algunas inestabilidades puntuales en los periodos I, IV y V.
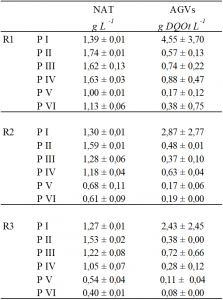
Respecto a la concentración deAGVs, éstos se producen durante la fase hidrolítica de la digestión anaerobia (figura 2). Si las fases hidrolítica y metanogénica funcionan correctamente, la concentración de AGVs en la mezcla debería ser estable y baja. A partir del periodo II, la concentración de AGVs se mantuvo en niveles inferiores a 1 g DQOt L-1 en los tres reactores durante todo el periodo de experimentación (tabla 3). Estas bajas concentraciones de AGVs unidas a los adecuados ratios AI/AP y valores de pH descartan una inhibición relacionada con la acidificación del sistema de digestión anaerobia e indican la estabilidad del mismo en todos los periodos de trabajo.
En el caso del nitrógeno amoniacal (NAT), éste procede en su mayor parte de la degradación de las proteínas durante la digestión anaerobia. Los niveles inhibitorios de NAT para los microorganismos metanogénicos se sitúan en un rango de concentraciones entre cuatro y 10 g NAT L−1.
Las concentraciones obtenidas durante los diferentes periodos de experimentación se situaron siempre por debajo de estos niveles inhibitorios. En la tabla 3 se puede observar que la máxima concentración de N fue de 1.7 g NAT L−1. Por tanto, se descarta una posible inhibición parcial del proceso relacionada con el NAT.
- Obtención de energía a partir del biogás producido
Para calcular la energía potencial que se obtendría a partir del biogás generado se considera como granja tipo una granja de vacuno de leche de tamaño medio (160 animales), con una producción anual de estiércol de 3212 t y una producción anual de lactosuero de 1339t.
De acuerdo con los resultados experimentales, se selecciona la mezcla de co-digestión con el 50% de lactosuero (aproximadamente 30% en volumen) utilizada durante el periodo V de la co-digestión de lactosuero y estiércol de vacuno en condiciones semicontinuas. Esto resulta en un volumen de lactosuero a tratar de 964 t, que sumados al estiércol haría un total de 4176 t de sustrato a tratar anualmente. Se supone que la planta trabajaría durante 7500 horas (313 días) al año con un rendimiento de metano de 229 mL CH4 g SV -1.La producción diaria de metano obtenida con esta mezcla sería de 128 m3 CH4, con una energía potencial de 1278 kWh al día (poder calorífico del metano de 9,96 kWh m-3).
Para la recuperación simultanea de electricidad y calor se considera un sistema de co-generación (CHP) de 100 kW con eficiencias del 30% para la recuperación de electricidad y del 50% para la recuperación de calor. Las producciones netas diarias de electricidad y calor serían de 383 kWhdía-1 y 639 kWhdía-1, respectivamente (tabla 4).
Conclusiones
Este estudio demuestra que la co-digestión de lactosuero con estiércol de vacuno es una forma óptima de valorización energética para ambos subproductos. La adición de un 50% de lactosuero (en base a sólido volátil) a la digestión anaerobia de estiércol de vacuno resultó en un incremento de la producción de metano del 36%, respecto a la digestión del estiércol como único sustrato. Además, la presencia de lactosuero incrementó la biodegradabilidad de la mezcla, obteniéndose un proceso estable de digestión anaerobia.
Agradecimientos
Este trabajo ha sido financiado por el Fondo Europeo Agrícola de Desarrollo Rural (FEADER ) a través del proyecto Lactocyl “La bioeconomía aplicada a la valorización del lactosuero en alimentación, transformación energética y obtención de bioproductos”.
Referencias
Asunis, F., De Gioannis, G., Dessì, P., Isipato, M., Lens, P.N., Muntoni, A., Polettini, A., Pomi, R., Rossi, A., Spiga, D., 2020. The dairy biorefinery: Integrating treatment processes for cheese whey valorisation. Journal of Environmental Management, 276, p.111240.
Fernández, C., Martínez, E.J., Morán, A., Gómez, X., 2016. Procesos biológicos para el tratamiento de lactosuero con producción de biogás e hidrógeno. Revisión bibliográfica. Revista Ion, 29(1).
Imeni, S.M., Pelaz, L., Corchado-Lopo, C., Busquets, A.M., Ponsá, S., Colón, J., 2019. Techno-economic assessment of anaerobic co-digestion of livestock manure and cheese whey(Cow, Goat & Sheep) at small to medium dairy farms. Bioresource Technology, 291, p.121872.
Junta de Castilla y León (JCYL) 2016. Disponible en: http://www.comunicacion.jcyl.es/web/jcyl/Comunicacion/es/Plantilla100Detalle/1281372051501//1284544930925/Comunicacion?d=1.
MAPA 2019. Vacuno de leche. Informe de base de datos económica. Ejercicio económico de 2019. Red Nacional de Granjas Típicas. Ministerio de Agricultura, Pesca y Alimentación (MAPA). Secretaría General Técnica. Centro de Publicaciones.
Molinuevo-Salces, B., Mahdy, A., Ballesteros, M., González-Fernández, C., 2015. From piggery wastewater nutrients to biogas: Microalgae biomass revalorization through anaerobic digestion. Renew. Energy 1–8.
Ramos, A.C., 2020. Gestión de residuos en las granjas de vacuno de leche (II): Caracterización de deyecciones y efluentes. Frisona española, 40(238), pp.96-101.
Rico, C., Muñoz, N., Rico, J.L., 2015. Anaerobic co-digestion of cheese whey and the screenedliquid fraction of dairy manure in a single continuously stirred tank reactor process: Limits in co-substrateratios and organic loading rate. Bioresource Technology, 189, pp.327-333.